近年來,我國將基因檢測作為國家重點領域,加大了支持力度,先后推出了多項政策、制度進行扶持,為行業的發展創造了良好的政策環境。
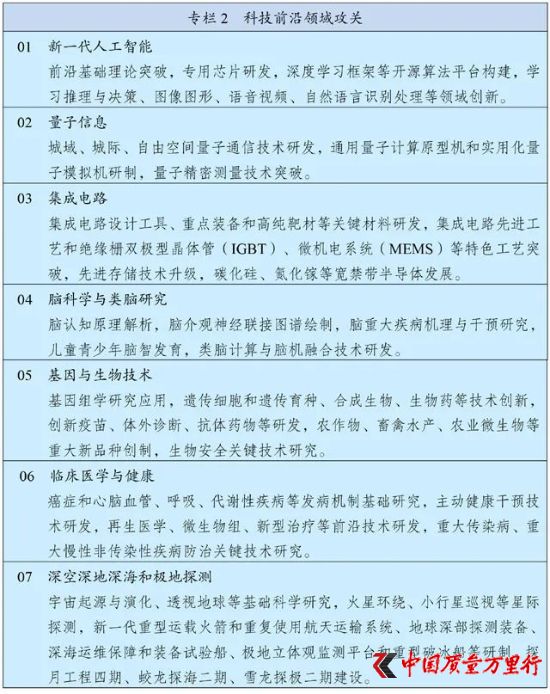
“十四五”規劃中提到的“基因與生物技術”
今年3月12日,《中華人民共和國國民經濟和社會發展第十四個五年規劃和2035年遠景目標綱要》正式發布,明確“基因與生物技術”作為七大科技前沿領域攻關領域之一;“生物技術”作為九大戰略性新興產業之一,其中“基因技術”為未來產業。
由于基因檢測涉及倫理、隱私和人類遺傳資源保護、生物安全等問題,早在2014年2月9日,原國家衛計委辦公廳以及原國家食藥局辦公廳聯合發布《關于加強臨床使用基因測序相關產品和技術管理的通知》,全面叫停基因檢測。該通知規定,在相關的準入標準、管理規范出臺以前,任何醫療機構不得開展基因測序臨床應用,已經開展的,要立即停止。
基因檢測叫停一個月后,2014年3月,原國家衛計委發布《關于開展高通量基因檢測技術臨床應用試點單位申報工作的通知》。通知要求已經開展高通量基因測序技術,且符合申報規定條件的醫療機構可以申請試點,并按照屬地管理原則向所在省級衛生計生行政部門提交申報材料,同時明確申請試點的基因測序項目,如產前篩查和產前診斷、遺傳病診斷、腫瘤診斷與治療、植入前胚胎遺傳學診斷等。
2015年,隨著政策方面逐漸轉暖,我國先后批準了一些大型的三甲醫院和有資質的第三方檢測中心,作為高通量基因測序在遺傳病、無創產前診斷及腫瘤診斷方面應用的試點單位。
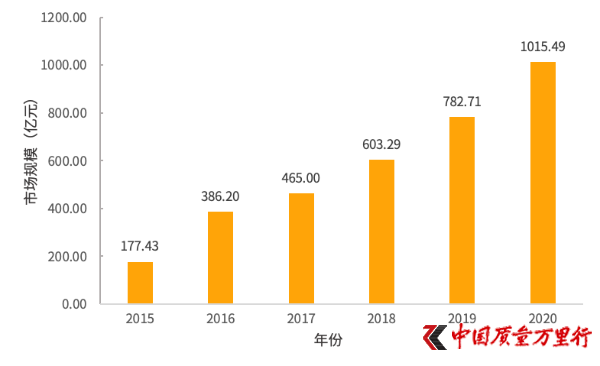
2015—2020年我國基因檢測行業市場規模(圖片來自:火石創告)
從2016年基因檢測正式寫入“十三五”規劃,到2020年《生物安全法》的出臺,五年間,我國基因檢測得到了有效監管與全面發展。
2016年,我國過先后發布了多條與之相關的關鍵性國家政策,基因檢測經歷了從產業發展倒逼政策改革,到以政策引導產業發展的階段。
3月,科技部下發了《國家重點研發計劃2016年度項目申報指南》的通知,其中“精準醫學研究”被列入優先啟動的重點專項,并正式進入實施階段。
4月15日,國家發改委下發了《國家發展改革委辦公廳關于第一批基因檢測技術應用示范中心建設方案的復函》(發改辦高技[2016]534號),正式批復建設全國27個基因檢測技術應用示范中心,鼓勵加快基因檢測產業的快速發展。
4月23日,中國臨床腫瘤醫學會發布的中國首部《腫瘤驅動基因分析聯盟(CAGA)二代測序技術臨床應用共識》,幫助指導基因檢測技術規范合理應用,給我國患者帶來更切實的治療。
7月,原國家衛計委公布了第一批二代基因測序技術臨床應用示范單位及遺傳病診斷等試點專業。
8月,國務院正式印發了《“十三五”國家科技創新規劃》,共提及“醫藥”一詞近20次,涉及了精準醫療、基因編輯、免疫治療、干細胞等多個熱門領域。
10月,原國家衛計委發布了《醫學檢驗實驗室基本標準(實行)》的管理文件,其中規定:開展產前篩查與產前診斷項目的實驗技術人員應具備產前篩查與診斷的相應資質。
11月7日,工信部、國家發改委、科學技術部、商務部、原國家衛生和計劃生育委員會與原國家食品藥品監督管理總局6部門聯合發布《醫藥工業發展規劃指南》,基因檢測正式寫入“十三五”規劃。
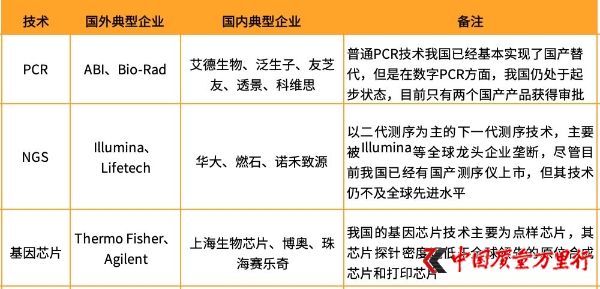
基因檢測技術典型企業(圖片來自:火石創告)
2017年,我國啟動十萬人基因組計劃,十三五規劃將發展基因技術作為生物醫藥產業創新的核心任務,在此背景下,以基因技術為核心的生物產業將獲得快速發展,帶動基因測序行業邁入爆發期。
1月,國家發展改革委發布《“十三五”生物產業發展規劃》規劃,基因檢測、細胞治療、免疫治療、基因編輯、產前篩查等多個熱門概念被“點名”,并且提出實現基因檢測能力(含孕前、產前、新生兒)覆蓋出生人口 50% 以上。
2月,基因科技正式寫入發改委1號文:《戰略性新興產業重點產品和服務指導目錄》。
6月,國家六個部委聯合發文:《“十三五”衛生與健康科技創新專項規劃》,規劃綱要明確要求加強基因治療、細胞治療等關鍵技術研究,加快生物治療前沿技術的臨床應用,創新治療技術,提高臨床救治水平。
12月,原國家衛計委重磅發布兩項個體化醫學指南《感染性疾病相關個體化醫學分子檢測技術指南》和《個體化醫學檢測微陣列基因芯片技術規范》。
12月28日,我國啟動“中國十萬人基因組計劃”,這是我國在人類基因組研究領域實施的首個重大國家計劃,也是目前世界最大規模的人類基因組計劃。分別涉及基因組計劃、高通量測序儀和新型分子診斷技術,其中新型分子診斷技術明確指出重點發展液體活檢、腫瘤和傳染病基因檢測等。
2018年,我國加大扶持精準醫療的浪潮仍在持續,“十三五”規劃等一系列利好政策的相繼出臺推動了基因測序行業的進一步發展;同時,日益完善的監管體系使得市場秩序更加有序,行業競爭日益規范。
1月,工信部發布《首臺(套)重大技術裝備推廣應用指導目錄》,共有32種醫療設備產品可以享受到“首臺套”推廣應用政策的扶持,醫療設備產品中包括高通量基因測序儀。
11月,科技部發布《已批準的人類遺傳資源行政許可項目信息匯總(2018第二十二批)》。對我國人類遺傳資源采集、收集、出口出境行為的審批流程做進一步規范和完善。
11月,國家衛健委發布《醫療技術臨床應用管理方法》正式實施,對禁止臨床應用的醫療技術實施負面清單管理,對部分需要嚴格監管的醫療技術進行重點管理。
12月,國家衛健委發布《關于印發全國出生缺陷綜合防治方案的通知》。明確規范廣泛開展產前篩查,逐步擴大篩查病種,規范應用高通量基因測序等新技術,促進早發現早治療,減少先天殘疾。
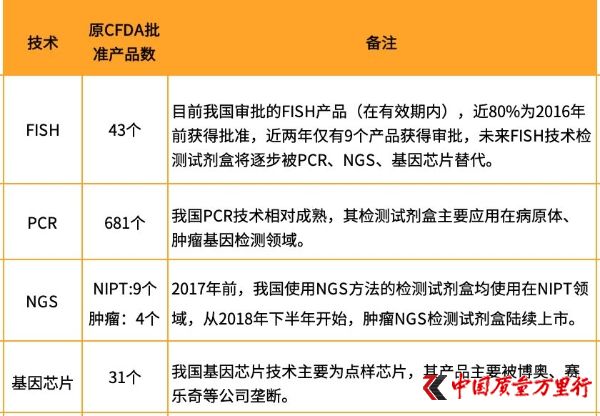
我國基因檢測試劑盒產品情況(圖片來自:火石創告)
2019年,《健康中國行動(2019—2030年)》明確提出“加快推動從以治病為中心”轉變為“以人民健康為中心”,彰顯預防是最經濟、最有效的健康策略,基因檢測也隨著“健康中國2030”上升為國家戰略之后成為健康產業的新風口。
4月,國家藥監局啟動了中國藥品監管科學行動計劃,藥審中心負責實施的“細胞和基因治療產品技術評價與監管體系研究”納入首批研究項目。
5月,由國家衛健委能力建設和繼續教育中心主辦的遺傳咨詢能力建設專家委員會在北京成立,旨在推動建立權威、科學、規范的遺傳咨詢師國家職業標準,彌補遺傳咨詢在國內的空白。
7月,國務院公布《關于實施健康中國行動的意見》,明確提出“加快推動從以治病為中心”轉變為“以人民健康為中心”,彰顯預防是最經濟、最有效的健康策略。
8月,中國首個PD-L1檢測試劑盒獲批上市,醫學進入精準醫學時代,精準的診斷尤為重要。
2020年,《2021基因行業藍皮書》中指出,應用發展的政策窗口期在2019-2020年打開,但恰逢人類遺傳資源管理、基因編輯及生物安全相關法規出臺,需要一定周期的規范化和市場教育。
3月,《微生物組測序與分析專家共識》發表于2020年生物工程學報。涵蓋從微生物采集與保存、DNA 提取與建庫、高通量基因測序和數據分析以及質控標準品等全流程。
3月,《臨床遺傳病基因檢測全流程規范化共識探討》發表于中華醫學遺傳學雜志。這是國內首個由“第三方基因檢測機構代表+臨床及科研專家”共同商討、基于基因科技發展和實際應用場景達成的行業共識。
7 月,第十三屆全國人大常委會第二十次會議對《中華人民共和國刑法修正案(十一)(草案)》進行了審議,首次將非法基因編輯、非法采集和使用國家人類遺傳資源等納入刑法規制范圍。
9月,國家藥品監督管理局藥品審評中心(CDE)發布《基因治療產品藥學研究與評價技術指導原則(征求意見稿)》。同月,國家藥品監督管理局也正式發布全球首個高通量基因測序儀標準,規范了上游數據生產的基本標準。
10月出臺的《生物安全法》,將人類遺傳資源有關活動的安全管理納入監管。
12月,國家衛健委連續印發《抗腫瘤藥物臨床應用管理辦法(試行)》及《新型抗腫瘤藥物臨床應用指導原則(2020 年版)》等文件,明確指出由國家衛生健康委發布的診療規范、臨床診療指南、臨床路徑或藥品說明書中規定需進行基因靶點檢測的靶向藥物,使用前需經靶點基因檢測,確認患者適用后方可開具。










 京公網安備11010502034432號
京公網安備11010502034432號